细胞是生命的基本单位。一个细胞中除了线粒体、内质网等我们熟知的细胞器外,还大量存在着没有固定结构的大分子,比如蛋白质、核酸和多糖等,它们就像“散兵游勇”在细胞里分分合合,看似简单、随机的变化却对细胞的生命有着精细的调控作用。随着科技手段的进步,科学家得以揭开这些神秘大分子的 “运作”规律,让我们看到仅仅是因为一些凝聚体的物理属性发生变化,细胞的活力就会发生翻天覆地的变化。
2024年1月3日,浙江大学生命科学研究院陆华松研究员与杨兵研究员团队合作在Nature Cell Biology期刊上发表题为A chaperone-like function of FUS ensures TAZ condensate dynamics and transcriptional activation的研究论文。该工作揭示了生物大分子凝聚体物质属性与其功能维持的紧密联系:在细胞时刻发生的“转录”过程中,FUS能扮演“分子伴侣样”角色,维持TAZ凝聚体的“液态”流动性,从而促进其转录活性。
1、细胞中的生物大分子凝聚体是一种怎样的存在?
答:细胞里的蛋白质、DNA和RNA等都属于生物大分子。有的生物大分子具有明确的结构和对应的功能,我们可以通过冷冻电镜等手段解出它们的结构,然后去探究结构与功能的对应关系。
然而细胞中还有一类大分子并没有组成固定的形状和结构,它们的功能是通过频繁的“凝聚”和“解离”来实现的。其中,“生物大分子凝聚体”是指大分子以微弱的相互作用力聚集在一起,通过“团队作战”实现某种功能;而“团队”所体现的软硬、大小、疏密等物理属性会对细胞产生重要的影响。已有许多表明,细胞中生物大分子凝聚体的形成是通过相分离来实现的。
2、 “相分离”、“相变”等概念都是用来大分子凝聚体的概念的吗?
答:其实“相分离”本身是一个物理化学概念。在特定条件下,二元或者多元混合体系会自发地分离形成不同的相。相分离现象无处不在,比如,我们喝的汤里飘着油花,是因为油不溶于水,两种液体产生分离,这种现象即为“液-液相分离”;再比如,液态的水蒸发成气态的水蒸气或者凝结成固态的冰,从一种相转变为另一种相的过程即为“相变”。
生命科学领域的“相分离”是一个既古老而又崭新的概念。早在1899年,美国生物学家Wilson就提出细胞质是多种液体混合以乳浊液形式存在的假设;但直到2009年,德国马普所的TonyHyman团队关于线虫P颗粒的研究才将相分离概念引入了生命科学研究。
P 颗粒是秀丽隐杆线虫生殖细胞中一种由蛋白质和RNA组成的无膜亚细胞结构。它最初在线虫的受精卵细胞质中均匀分布,随着不对称分裂的发生,逐渐在受精卵的后部富集,并被分配给一个子代细胞。P颗粒是如何从均匀分布向不对称分布转变?这在很长一段时间内没有得到完全阐释。Tony Hyman团队发现,P颗粒并不是固体结构,而是像“液滴”一样存在表面张力,可以快速地融合、消散。据此,Hyman团队提出P颗粒在生殖细胞内以相分离的形式存在,自此将相分离概念引入生物学领域。而现在我们知道,我们身体的每一个细胞里也时刻发生着相分离。生物大分子蛋白质、DNA和RNA都可以参与相分离,形成凝聚体,调控着各种生命活动的进行。
3、什么是无膜亚细胞结构?它和细胞器是有什么异同?
答:细胞内的复杂生化过程必须在时间和空间上得到精确调控。细胞主要通过两种方式实现生物大分子的区室化调控。首先,各种经典的有膜细胞器,如线粒体、内质网等,可通过膜结构产生物理隔离,将生物大分子限定在相对独立的亚细胞结构中,实现区室化调控。
细胞内还存在众多的无膜亚细胞结构。尽管它们没有生物膜包被,但同样可以实现生物大分子的区室化调控。细胞内的这些无膜亚细胞结构种类繁多,形成机制迥异,其中的一些甚至在光学显微镜时代就已经被观察到。细胞核内的核仁在人们早期观察细胞时就被发现,它是核糖体RNA转录、加工、核糖体亚基组装的场所。
随着2009年相分离概念的引入,科学界认识到细胞内非常多的无膜亚细胞结构具有显著的相分离特征,例如应激颗粒、P小体、卡哈尔体等。比如,细胞质中的应激颗粒在细胞受到刺激时快速形成,而在压力消失时解聚,被认为可以帮助细胞抵抗外部环境变化。
4、能否解释一下,生物大分子凝聚体有哪些物质属性?它们对于功能维持会产生什么影响?
答:我们关注的生物大分子凝聚体的物质属性主要是指凝聚体内分子的流动性,流动性强的液态凝聚体可与周边环境发生频繁的分子交换,从而可以快速地响应各种信号变化,反之,凝聚体向胶状或固态转变后,内部的分子互作加强,流动性降低,功能活性自然就会大打折扣。因此,我们的研究提出,生物大分子凝聚体内存在分子伴侣样功能的因子,以维持生物大分子凝聚体的流动性和功能。
5、在这项研究中,你关注到的是HIPPO细胞信号通路下游的一个转录因子TAZ。能否介绍一下什么是细胞信号通路?它们是不是大多以凝聚体的方式存在?
答:细胞信号通路是指细胞内或细胞间发生的一系列化学反应和信号传递事件。当细胞外的分子信号,比如激素、神经递质或细胞因子等,与细胞表面的受体结合时,信号通路被激活并开始传递信号,就像多米诺骨牌一样环环相扣,最终传递至细胞内做出特定反应。
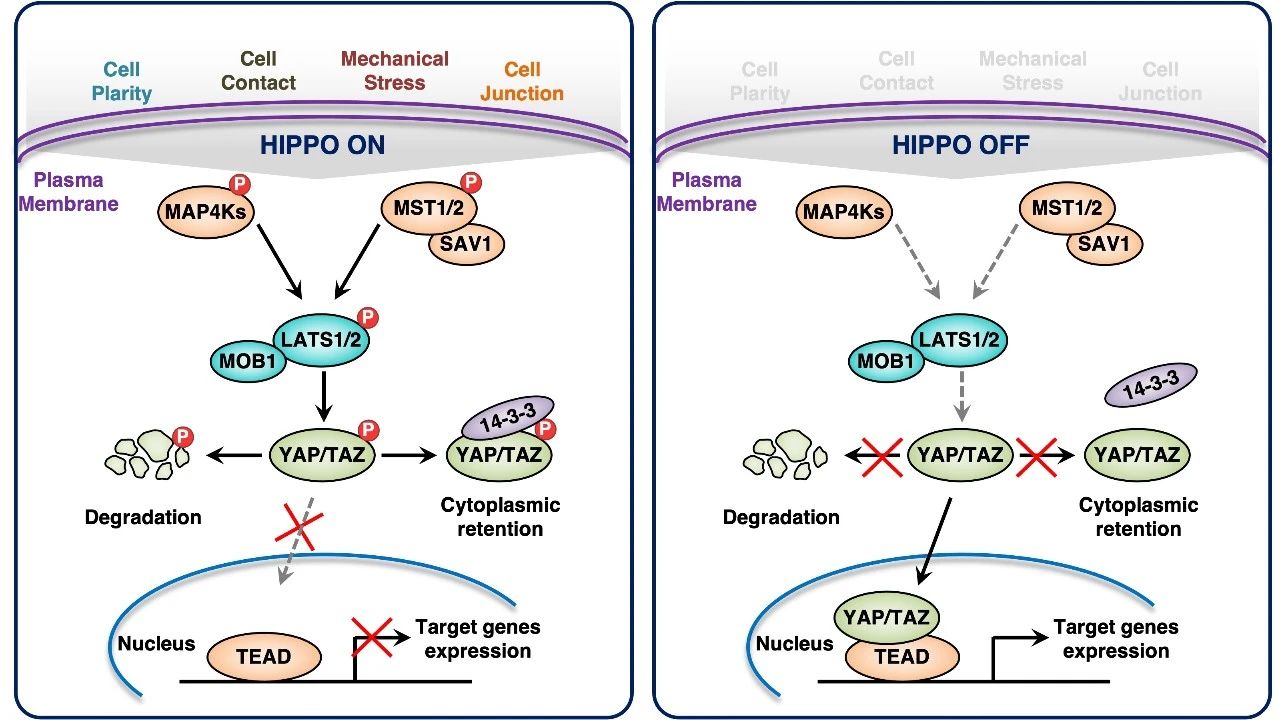
图:Hippo信号通路
其中,Hippo信号通路在调控细胞增殖、凋亡和干细胞自我更新等一系列生命活动中发挥重要作用。TAZ和YAP作为Hippo下游的两个效应因子,它们具有相分离的能力,能够形成凝聚体促进下游基因的转录。已有的研究发现,Hippo通路上游的激酶几乎都受到其他生物大分子凝聚体的调控[,相分离凝聚体参与调控其他信号通路的研究发现也是屡见不鲜,因此,我们相信凝聚体的调控已经渗透到细胞各个生理活动的方方面面。
6、你是通过什么方式发现TAZ具有不同的“相”?如何判断TAZ的流动性发生了变化?
答:TAZ凝聚体由相分离介导形成,具有类似液滴的属性,可以不断地融合、消散,动态可逆以维持平衡。基于前期的实验结果,我们大胆猜测TAZ凝聚体的这种动态流动性是其功能实现的关键。通过一次体外实验,我们将纯化的TAZ蛋白诱导相分离形成后,进行长时间孵育,果然发现TAZ凝聚体会从圆圆的液滴状逐渐变成大块粘滞的胶状,肉眼可见的发生了“相”改变。而当在实验体系中加入FUS蛋白后,TAZ凝聚体向“固态”转变的过程被极大地延缓了。
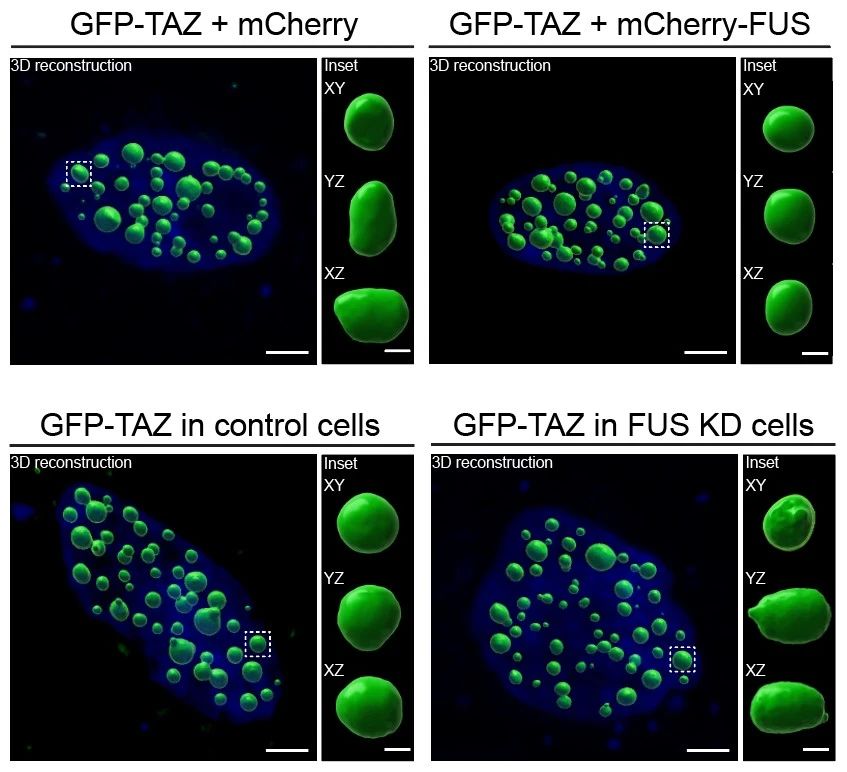
图:不同条件下GFP-TAZ凝聚体的3D重构和形态展示
为了进一步表征TAZ凝聚体的物质属性变化,我们还进行了荧光漂白恢复实验(FRAP)。此外,我们还运用多层成像技术对细胞内的TAZ凝聚体进行3D重构,还原TAZ凝聚体的形态。同样的,具有“液滴”属性的凝聚体形状更加规则圆润,而具有“固化”特征的凝聚体普遍具有不规则的形态。
7、FUS是如何发挥“分子伴侣样”功能维持TAZ凝聚体“液态”的?
答:TAZ主要通过其CC结构域的多价互作介导相分离发生,形成凝聚体,而FUS的N端结构域LCD可以与TAZ的CC结构域直接互作,破坏多价性从而显著地限制TAZ凝聚体的形成。而磷酸化后的FUS-LCD则无法与TAZ-CC互作,失去了对TAZ凝聚体的抑制作用,FUS-LCD的磷酸化受DNA-PK调控。FUS与TAZ凝聚体的抑制作用可以防止TAZ凝聚体从液态向固态转变,保持最佳的流动性。
8、这里您和杨兵老师合作,使用了交联质谱技术,能否简单地介绍一下这项技术?
答:简单来说,交联质谱技术就是将化学交联剂与质谱技术相结合使用。在蛋白质样品中加入适量的化学交联剂,交联剂就像“订书钉”一样,将蛋白质组合“钉”在一起形成交联产物,我们再通过质谱仪分析检测获得想要的信息。
交联质谱技术的优势在于可以捕获弱的、瞬时的分子相互作用,而这些作用力通常普遍存在于相分离凝聚体中。因此,在研究中,我们就利用这项技术对体外重构的TAZ凝聚体的组分进行了解析。
9、这项研究最难的地方在哪里?你是怎么解决这个难题的?
答:我认为最难的部分是如何解析TAZ凝聚体的组成成分。因为介导相分离发生的作用力通常为瞬时的弱相互作用力,很难通过传统的手段去捕捉相分离状态下的蛋白互作。而交联质谱技术是近年来兴起的一项研究蛋白互作的强大技术,我们就想到了与杨兵老师实验室进行合作。
而在这项研究中,我们利用了杨兵老师实验室改造的一个新型交联剂L-NHSF,相比于改造前,L-NHSF的连接臂更长更灵活,并且通过一系列预实验证明它具有更强的交联活性,并且适合用于相分离状态下的蛋白质交联。这项工作也体现了多学科交叉的优势。
10、围绕“生物大分子凝聚体物质属性与其功能维持”,您还有哪些相关的研究可以分享一下吗?
答:通过本项研究,以及近期同行们的相关研究,我们更加坚定了生物大分子凝聚体的的物质属性变化会影响其功能活性这样的概念,而凝聚体的物质属性是如何被精密调控的?尤其是一些应激压力下,细胞又将如何应对?近期,我们正在开展的课题中,有涉及热激、高渗等压力条件下的凝聚体物质属性调控与功能的研究,期待未来能取得新的研究成果与大家分享。
11、目前人们关于细胞中的凝聚体的认识,是不是还是刚刚起步的阶段?您认为随着研究的深入,最后这个研究领域会为我们揭开关于生命的哪些奥秘?
答:自2009年Hyman 团队证明线虫中的P 颗粒具有液滴的属性,将相分离的概念引入生物学,领域内开始系统研究细胞中相分离凝聚体的时间其实不到10年。目前整个领域内,已经建立了研究相分离凝聚体的研究方法,解析了相分离凝聚体形成的分子特异性,以及异常相分离与疾病存在联系等等。
但随着研究的深入,已获取的知识会引发更多的科学问题。比如细胞中的无膜结构到底是如何形成的?细胞中的复杂的各种生命活动又是如何通过相分离凝聚体被精密调控的?神经退行性疾病中凝聚体的异常相变是如何发生的?这种异常相变能否,又将以何种方式被逆转?此外,我们还需要更多的实验工具用于研究细胞内无膜凝聚体的结构和动态调控机制,开发检测细胞内凝聚体物质属性的新方法等。这些工作将完善我们对细胞内生物大分子区室化调控这一核心问题的理解,为靶向凝聚体的治疗和药物设计提供新思路。
12、您下一步的研究会关注哪方面?下一步是否有计划和其他学科领域的学者开展合作?
答:我们后续的研究还会继续聚焦于相分离凝聚体的相关研究,为了更好地阐释应激压力下的凝聚体物质属性调控机制及其功能变化的关系,我们特别希望能跨学科合作,比如和物理、化学、材料等领域的研究团队合作,开发新技术以解析细胞内凝聚体这种软物质的物理特性,更加直接地表征凝聚体物质属性的变化规律。
论文链接:
https://www.nature.com/articles/s41556-023-01309-3
来源: 浙江大学学术委员会

